检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
抗体是人体免疫防御系统中的关键分子。2025年11月6日,北京大学肖俊宇教授与高宁教授研究团队联合在Science Advances上发表了题为“Xenopus IgX informs engineering strategies of IgM and IgG hexamers”的研究论文。本研究在追溯抗体分子演化的过程中,从非洲爪蟾中的IgX抗体得到了启发,开发了一种适用于构建人源IgM和IgG六聚体的策略,为相关大分子药物的设计提供了新思路。
IgM抗体在演化上最为古老,广泛存在于有颌脊椎动物中。在哺乳动物中,IgM通过其重链末端18个氨基酸组成的“尾片(tailpiece, tp)”区域与J链结合,组装成稳定的五聚体 (1)。这一组装形式不仅维持了IgM五聚体的稳定性,还使得J链以独特的方式参与和 IgM受体、及结合蛋白的相互作用,从而调节IgM的功能 (1–4)。在缺乏J链的情况下,IgM可形成部分六聚体及四聚体、五聚体等聚合形式。除了能以多价态的方式结合并中和病原,IgM 还能高效激活补体系统,协同清除病原和异常细胞 (5, 6)。值得注意的是,天然IgM六聚体的含量虽然很低,但由于在结构上与C1q的六聚体结构更为匹配,因此比IgM五聚体具有更强的补体激活能力 (7–10)。
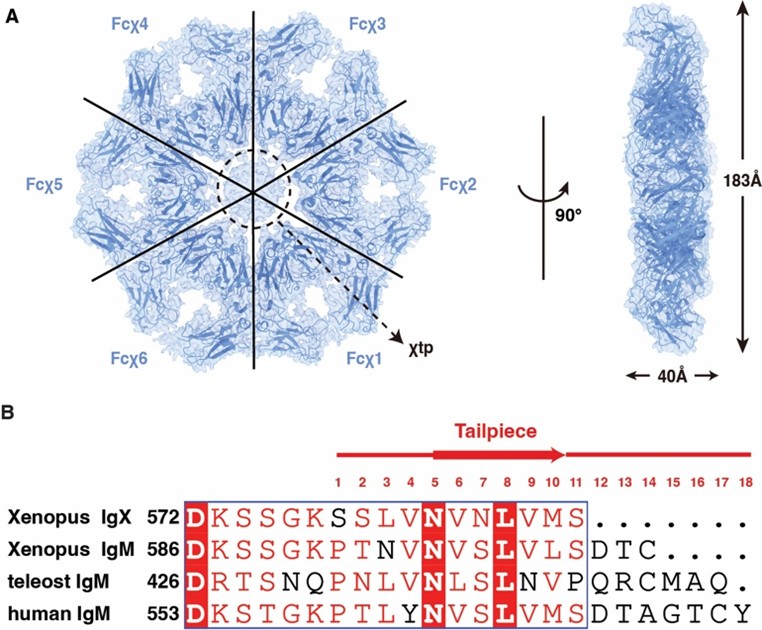
图1. IgX-Fc六聚体的冷冻电镜结构
非洲爪蟾中的IgX抗体是抗体演化的一个独特分支。本研究首先发现,IgX可不依赖J链而自主组装成稳定的六聚体(图1A)。与 IgM不同,IgX 的tp区域(χtp)仅包含11个氨基酸(图1B);去除这一区域破坏IgX 形成六聚体的能力,说明χtp 对于IgX六聚体 的形成至关重要。通过冷冻电镜技术,本研究解析了IgX-Fc六聚体的结构。在采用C1对称性计算获得的冷冻电镜密度图中,χtp区域的分辨率较低。采用C6对称性扩展的方法对复合物颗粒进行处理后,χtp区域的β-折叠构象特征得以显现。
为了进一步探究χtp 介导六聚体形成的能力,本研究接下来将人源IgM的tp (μtp) 替换为IgX的χtp。结果显示,获得的嵌合体(Fcμ-χtp)在没有J链的情况下,也能高效组装成均一的六聚体。据此结果,推测tp的长度可能是调控六聚体形成的关键。随后,将人源IgM的μtp 逐步截短,发现μtp的长度在11-16个氨基酸之间均可以实现均一的六聚体组装(图2A-B)。从分子机制的角度,少于11个氨基酸的μtp会损害β-折叠的完整性,从而破坏IgM六聚体的稳定性;而超过16个氨基酸的μtp则会因空间位阻效应阻碍六聚体形成。具体而言,倒数第二位的Cys575与末端Tyr576参与IgM-Fc与J链的相互作用,更加有利于 IgM-J五聚体的组装,但会影响六聚体的形成。
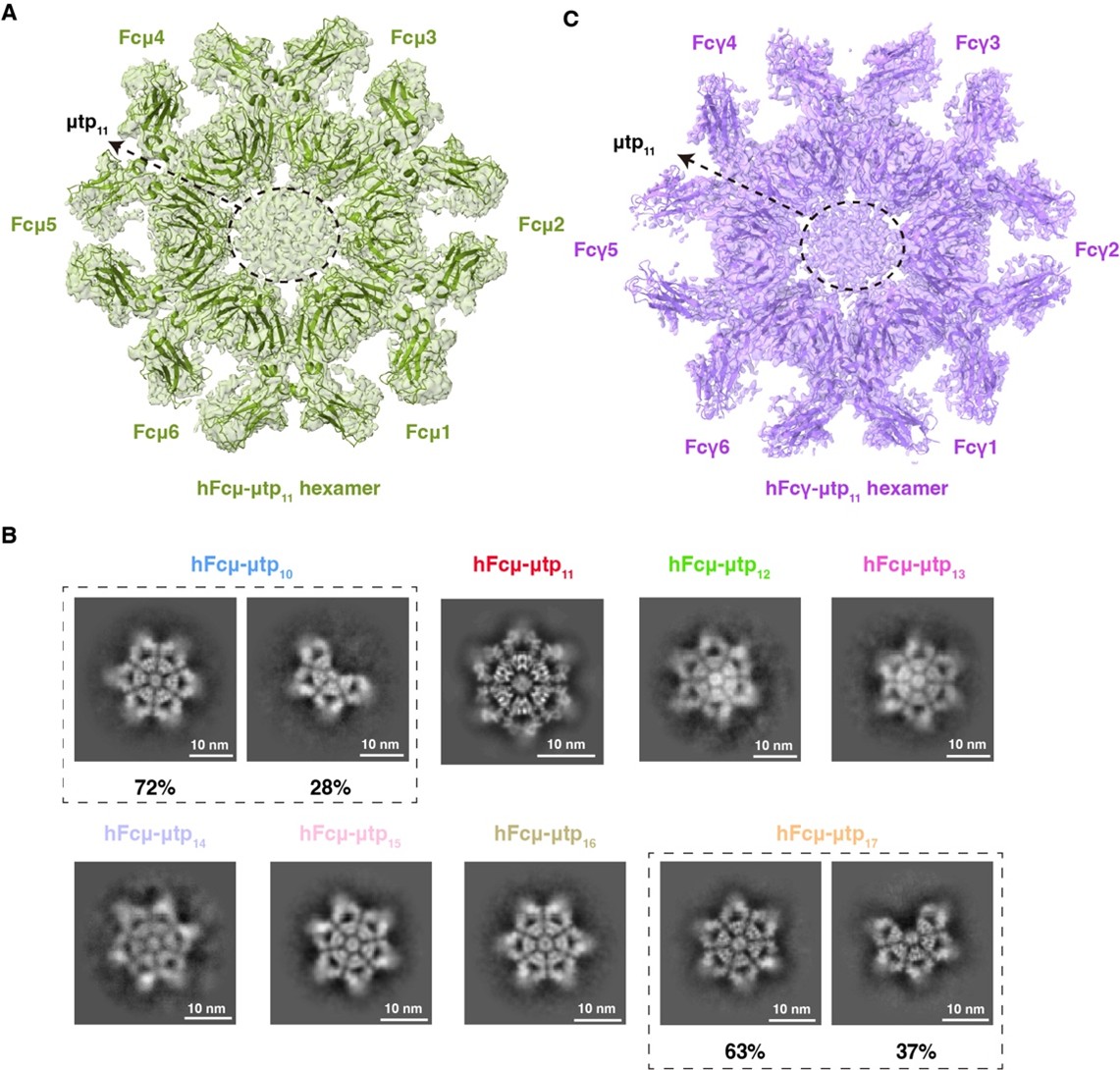
图2. 改造后 IgM-Fc 和 IgG-Fc六聚体的冷冻电镜结构
值得一提的是,将来自 IgM 的截短的μtp(μtp11)引入人源IgG,也能构建出稳定的IgG六聚体(图2C)。在功能验证中,本研究设计了靶向CD20的IgM与IgG六聚体,并在OCI-Ly10、Daudi、Raji等多种B淋巴瘤细胞中测试其杀伤效果。结果显示,这些工程化的六聚体抗体在细胞层面展示显著增强的补体依赖性细胞毒性(complement-dependent cytotoxicity, CDC)(图3A)。此外,改造后的IgG-Fc六聚体还可以作为“分子诱饵”,在细胞层面抑制过度激活的补体反应(图3B)。
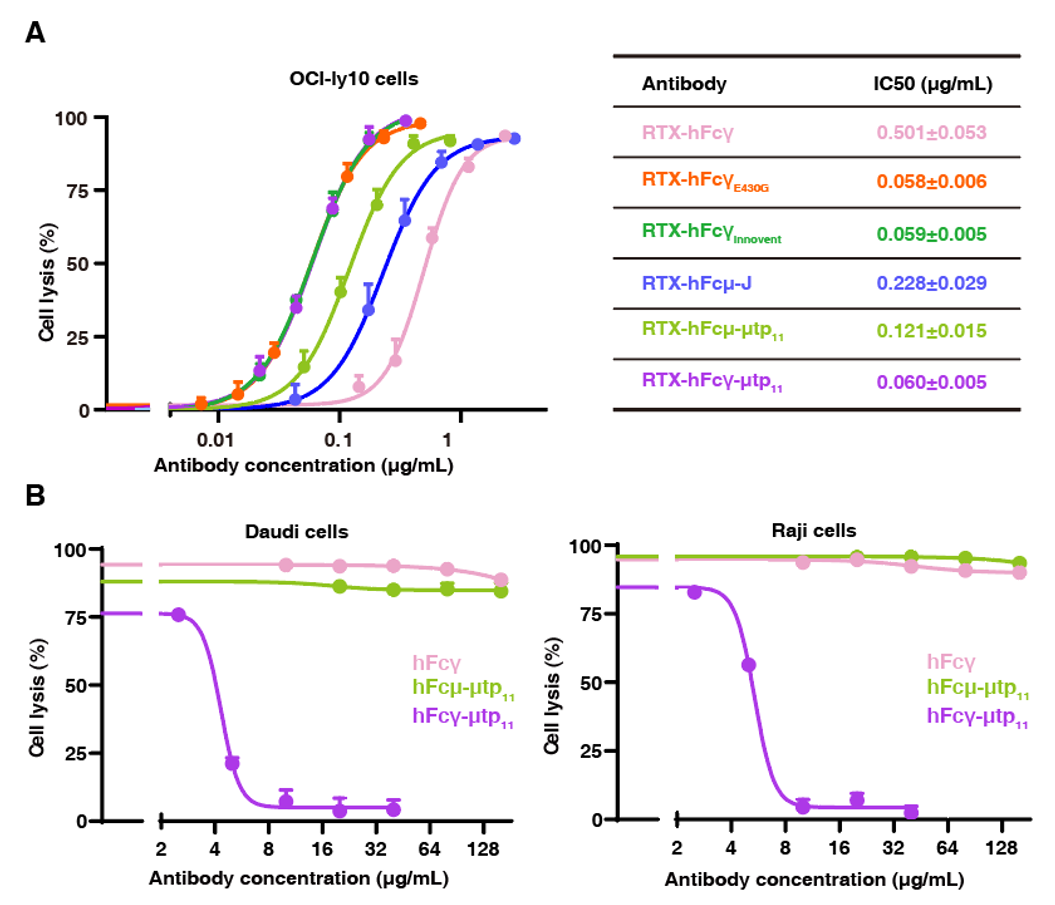
图3. 改造后抗体的功能表征
总结来说,这项研究从分子演化的角度揭示了一种天然六聚抗体的构造原理,并据此发展出一种通用策略,通过嵌合χtp或截短的μtp序列,高效诱导IgM或IgG六聚体的形成。工程化的IgM-Fc六聚体也有望作为分子骨架,展示其它具有生物活性的蛋白,从而拓展其应用潜力。本工作深化了我们对多聚免疫球蛋白演化的认识,也为开发新型生物制剂提供了一项平台技术。
北京大学生命科学学院/BIOPIC博士后张瑞雪(北京大学CLS项目博士毕业)和已出站博士后纪成功为该论文的共同第一作者。肖俊宇教授(基因功能研究与操控全国重点实验室、北京大学生命科学学院/BIOPIC、北大-清华生命科学联合中心、昌平实验室)和高宁教授(膜生物学全国重点实验室、北京大学生命科学学院、北大-清华生命科学联合中心、昌平实验室)、以及纪成功博士为该论文的共同通讯作者。北京大学生命科学学院博士研究生李姝涵和李宁宁研究员为该工作做出了重要贡献。该研究得到了国家自然科学基金委、国家重点研发计划、北京大学生命科学学院启东产业创新基金、北京大学成都前沿交叉生物技术研究院创新基金的资助。北京大学和昌平实验室冷冻电镜平台对数据的收集和处理给予了大力支持。
原文链接:https://doi.org/10.1126/sciadv.aea3737
参考文献:
1. Y. Li, G. Wang, N. Li, Y. Wang, Q. Zhu, H. Chu, W. Wu, Y. Tan, F. Yu, X. D. Su, N. Gao, J. Xiao, Structural insights into immunoglobulin M. Science 367, 1014-1017 (2020).
2. Y. Li, H. Shen, R. Zhang, C. Ji, Y. Wang, C. Su, J. Xiao, Immunoglobulin M perception by FcmuR. Nature 615, 907-912 (2023).
3. N. Oskam, M. A. den Boer, M. V. Lukassen, P. Ooijevaar-de Heer, T. S. Veth, G. van Mierlo, S.-H. Lai, N. I. Derksen, V. Yin, M. Streutker, CD5L is a canonical component of circulatory IgM. Proceedings of the National Academy of Sciences 120, e2311265120 (2023).
4. Y. Wang, C. Su, C. Ji, J. Xiao, CD5L associates with IgM via the J chain. Nat Commun 15, 8397 (2024).
5. E. S. Reis, D. C. Mastellos, G. Hajishengallis, J. D. Lambris, New insights into the immune functions of complement. Nat Rev Immunol 19, 503-516 (2019).
6. D. Ricklin, G. Hajishengallis, K. Yang, J. D. Lambris, Complement: a key system for immune surveillance and homeostasis. Nat Immunol 11, 785-797 (2010).
7. J. K. Wright, J. Tschopp, J. C. Jaton, J. Engel, Dimeric, trimeric and tetrameric complexes of immunoglobulin G fix complement. Biochem J 187, 775-780 (1980).
8. C. A. Diebolder, F. J. Beurskens, R. N. de Jong, R. I. Koning, K. Strumane, M. A. Lindorfer, M. Voorhorst, D. Ugurlar, S. Rosati, A. J. Heck, J. G. van de Winkel, I. A. Wilson, A. J. Koster, R. P. Taylor, E. O. Saphire, D. R. Burton, J. Schuurman, P. Gros, P. W. Parren, Complement is activated by IgG hexamers assembled at the cell surface. Science 343, 1260-1263 (2014).
9. D. Ugurlar, S. C. Howes, B. J. de Kreuk, R. I. Koning, R. N. de Jong, F. J. Beurskens, J. Schuurman, A. J. Koster, T. H. Sharp, P. Parren, P. Gros, Structures of C1-IgG1 provide insights into how danger pattern recognition activates complement. Science 359, 794-797 (2018).
10. L. Abendstein, D. J. Dijkstra, R. T. N. Tjokrodirijo, P. A. van Veelen, L. A. Trouw, P. J. Hensbergen, T. H. Sharp, Complement is activated by elevated IgG3 hexameric platforms and deposits C4b onto distinct antibody domains. Nat Commun 14, 4027 (2023).