检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
地球生命的繁荣离不开氧的参与。一方面,氧是好氧生物在分解代谢中高效获取能量所必需的;另一方面,机体又必须严格控制其在代谢过程中因电子泄漏所产生的活性氧(reactive oxygen species,ROS)。低水平的ROS可作为信号分子参与多种生理过程的调控;然而,过量的ROS则会引发脂质过氧化等反应,干扰细胞增殖与代谢,甚至导致细胞死亡【1–3】。
脂滴是一种由单层磷脂包裹的细胞器,近年来被发现在细胞抵御脂质过氧化过程中起重要作用。2015年,一项在黑腹果蝇(Drosophila melanogaster)中的研究首次表明,氧化应激条件下,果蝇幼虫脑胶质细胞中会大量积累脂滴。这些脂滴将容易发生脂质过氧化的多不饱和脂肪酸以甘油三酯的形式储存在其疏水核心中,有效限制全脑脂质过氧化水平的上升【4】。在随后的十年中,这一机制在睡眠调控、阿尔茨海默病、肿瘤等多种生理和病理过程中得到广泛验证【5-7】。然而,目前尚不清楚为何在氧化应激状态下脂滴能够积累。
2025年8月26日,北京大学生命科学学院、北大-清华生命科学联合中心朱健/刘敏团队在Molecular Cell在线发表了题为A regulator of amino acid sensing links lipid peroxidation and lipid droplet-dependent antioxidant response的研究论文,针对该问题提供了关键答案。该研究以果蝇幼虫脑胶质细胞为模型,发现氨基酸感知调节蛋白Hsc70-4能够感应脂质过氧化信号,进而启动脂滴的积累过程,以应对氧化应激引起的脂质过氧化损伤。
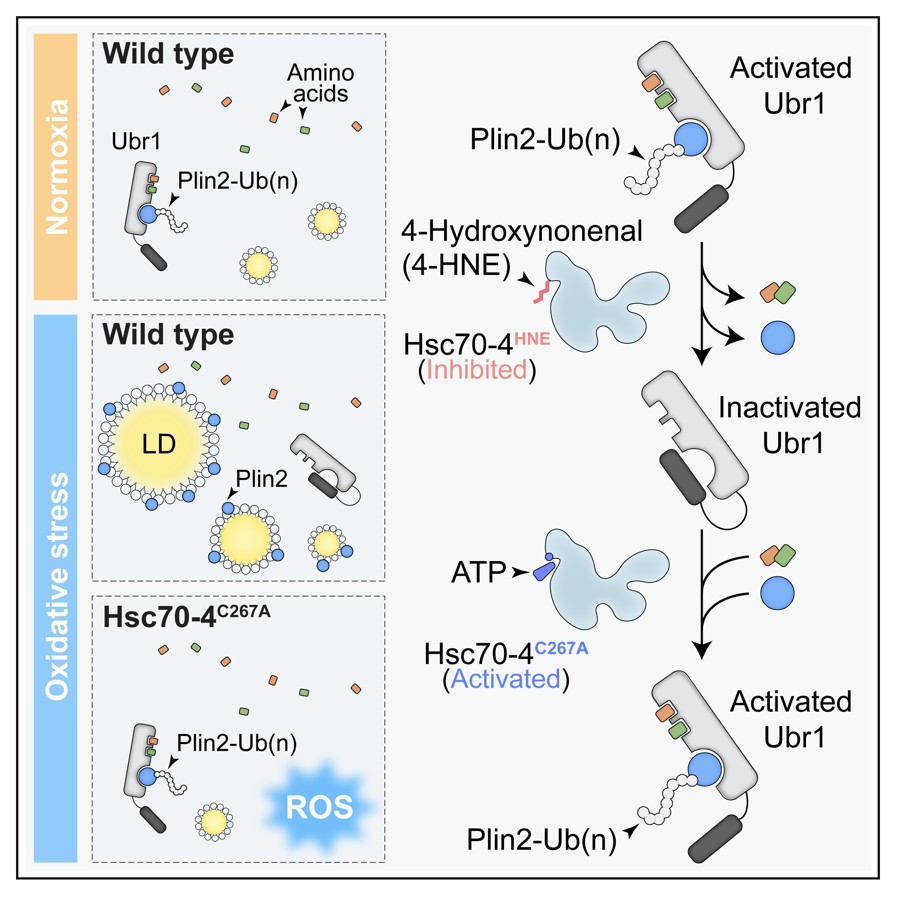
氧化应激状态下,脂质过氧化产物4-HNE通过抑制分子伴侣Hsc70-4和E3泛素连接酶Ubr1介导的氨基酸感知通路,诱导细胞内脂滴积累,从而形成一种抵抗氧化应激的保护性应答。
团队前期的研究发现:E3 泛素连接酶 Ubr1 可直接结合 7 种必需氨基酸(精氨酸、赖氨酸、组氨酸、亮氨酸、异亮氨酸、色氨酸和苯丙氨酸)并被激活,进而催化脂滴保护蛋白 Plin2 的多聚泛素化及蛋白酶体降解,防止脂滴过度增多【8】。在本研究中,作者进一步揭示Ubr1 的氨基酸结合能力并非恒定不变,而是受分子伴侣 Hsc70-4 以 ATP 酶活性依赖的方式精细调控。在氧化应激条件下,脂质过氧化产物4-羟基壬烯醛(4-hydroxynonenal,4-HNE)会共价修饰Hsc70-4第267位的半胱氨酸,抑制其ATP酶活性,使其无法维持Ubr1的氨基酸结合能力,导致Ubr1失活、Plin2泛素化降解减少,最终引发脂滴积累。研究还证实,该机制在人类正常胶质细胞和胶质瘤细胞中同样保守。通过定向清除HSPA8(果蝇Hsc70-4的同源蛋白)上的4-HNE修饰,可显著抑制胶质瘤生长。
传统观点认为,氨基酸感应蛋白对配体的亲和力是恒定的,细胞需借助不同感应器以应对细胞内外的氨基酸浓度波动。本研究首次发现,Ubr1的氨基酸感应能力受到Hsc70-4的动态调控,这一发现为重新审视CASTOR、Sestrin2、Sar1b等其他氨基酸感应蛋白是否也具有类似的“可变灵敏度”提供了新视角。
此外,该研究还指出脂质过氧化产物4-HNE不仅是铁死亡的生物标志物,更充当了一种危险信号分子。瞬时、低剂量的4-HNE通过修饰Hsc70-4触发脂滴聚集,有助于细胞抵御脂质过氧化损伤;而持续、高浓度的4-HNE则可能对多种生物大分子造成广泛修饰,最终导致细胞死亡。“过犹不及”这一源自古老智慧的哲学观念,在生命演化的过程中被赋予了深刻的分子内涵。它不仅体现了生命调控的精密与平衡,也为人类理解疾病发生与发展提供了关键启示。
北京大学生命科学学院博士研究生李锦华、北京大学成都前沿交叉生物技术研究院张延松博士、北京大学生命科学学院已毕业本科生彭靖予(现为哈佛大学博士研究生)和首都医科大学附属北京儿童医院杨伟博士是该论文的共同第一作者,北京大学生命科学学院朱健教授、刘敏副研究员和首都医科大学葛明教授是本文的共同通讯作者。该研究得到了北京大学生命科学学院于翔教授课题组的大力支持。
原文链接:https://doi.org/10.1016/j.molcel.2025.08.009
参考文献
1. Sies, H. and Jones, D.P. (2020). Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nat. Rev. Mol. Cell Biol. 21, 363-383.
2. Sies, H., Mailloux, R.J., and Jakob, U. (2024). Fundamentals of redox regulation in biology. Nat. Rev. Mol. Cell Biol. 25, 701-719.
3. Glorieux, C., Liu, S., Trachootham, D., and Huang, P. (2024). Targeting ROS in cancer: rationale and strategies. Nat. Rev. Drug Discov. 23, 583-606.
4. Bailey, A.P., Koster, G., Guillermier, C., Hirst, E.M., MacRae, J.I., Lechene, C.P., Postle, A.D., and Gould, A.P. (2015). Antioxidant role for lipid droplets in a stem cell niche of Drosophila. Cell 163, 340-353.
5. Haynes, P.R., Pyfrom, E.S., Li, Y., Stein, C., Cuddapah, V.A., Jacobs, J.A., Yue, Z., and Sehgal, A. (2024). A neuron-glia lipid metabolic cycle couples daily sleep to mitochondrial homeostasis. Nat. Neurosci. 27, 666-678.
6. Goodman, L.D., Ralhan, I., Li, X., Lu, S., Moulton, M.J., Park, Y.J., Zhao, P., Kanca, O., Ghaderpour Taleghani, Z.S., Jacquemyn, J., et al. (2024). Tau is required for glial lipid droplet formation and resistance to neuronal oxidative stress. Nat. Neurosci. 27, 1918-1933.
7. Cheng, X., Geng, F., Pan, M., Wu, X., Zhong, Y., Wang, C., Tian, Z., Cheng, C., Zhang, R., Puduvalli, V., et al. (2020). Targeting DGAT1 ameliorates glioblastoma by increasing fat catabolism and oxidative stress. Cell Metab. 32, 229-242.
8. Zhang, Y., Lin, S., Peng, J., Liang, X., Yang, Q., Bai, X., Li, Y., Li, J., Dong, W., Wang, Y., et al. (2022). Amelioration of hepatic steatosis by dietary essential amino acid-induced ubiquitination. Mol. Cell 82, 1528-1542.
朱健教授课题组现诚聘博士后研究人员,并同时招收博士研究生。课题组致力于深入解析脂代谢的调控机制及其在相关疾病发生与发展中的重要作用。我们诚挚欢迎具有生命科学、医学、化学、生物信息学或其他相关交叉学科背景的优秀青年人才加入我们的研究团队,共同推动这一前沿科学领域的创新与突破。