检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
“学之所知,忆之所存,遂成吾身。”
——埃里克·坎德尔(Eric R. Kandel)
大脑是我们体内最复杂、精妙和神秘的器官。人类大脑包含上千亿颗神经元,分属超过3000种不同类型,但都源自胚胎发育早期数量有限的神经干细胞 1。为了产生如此数量惊人且种类繁多的神经元,神经干细胞需不断进行不对称分裂, 在自我复制的同时分化产生神经祖细胞、前体细胞或终末分化的神经元等 2。神经发生过程出现异常可能导致小脑畸形、儿童脑瘤、精神分裂症及自闭症谱系障碍等神经发育疾病。
然而,有丝分裂作为神经发生的基石,却给细胞命运或身份的跨代继承带来了巨大挑战。细胞在进入有丝分裂后,染色质高度凝集成染色体,绝大多数构成基因调控网络的元件,如转录因子和染色质重塑因子等,从染色体上剥离或降解,转录活动几乎完全停滞,三维染色质结构也发生翻天覆地的变化 3-5。在脑发育中,神经干细胞何以在退出有丝分裂后精确、及时地“重建”其独特基因调控网络和染色质三维结构,实现其细胞命运记忆的跨代传递和继承是领域内一个关键但悬而未决的谜题。
在近期的相关研究中,宋艳团队发现有丝分裂书签不但可以帮助神经干细胞精确储存并跨代传递其自我复制的细胞记忆 (Shen et al., Molecular Cell, 2025) 6, 亦可以通过选择性删除相关细胞记忆,驱使新生神经元彻底忘记其进行自我复制的“前世”,在“今生”当好终末分化的神经细胞 (Liu et all., Developmental Cell, 2000) 7。然而,在神经干细胞进行不对称分裂生成两个命运迥然不同的子代细胞的过程中,细胞记忆是如何被不对称地传递和继承的呢?换句话说,细胞命运记忆是如何在一个子代细胞中被精确保存而在另一个子代细胞中被及时删除的呢?

2025年8月25日,北京大学生命科学学院、生命科学联合中心宋艳课题组在国际知名学术期刊Nature Communications上在线发表了题为“Dual mitotic bookmarking by GAF and H3K27ac orchestrates differential propagation of cell fate memory in neural development” 的最新研究成果 8。该研究发现神经干细胞在不对称分裂后,其命运记忆在姐妹子细胞中以差异化方式保留或重写。这种细胞命运记忆的差异性传承是通过先锋因子GAF与组蛋白修饰H3K27ac的拮抗性双重有丝分裂书签标记联合SWI/SNF复合体介导的选择性分子竞争共同实现的。
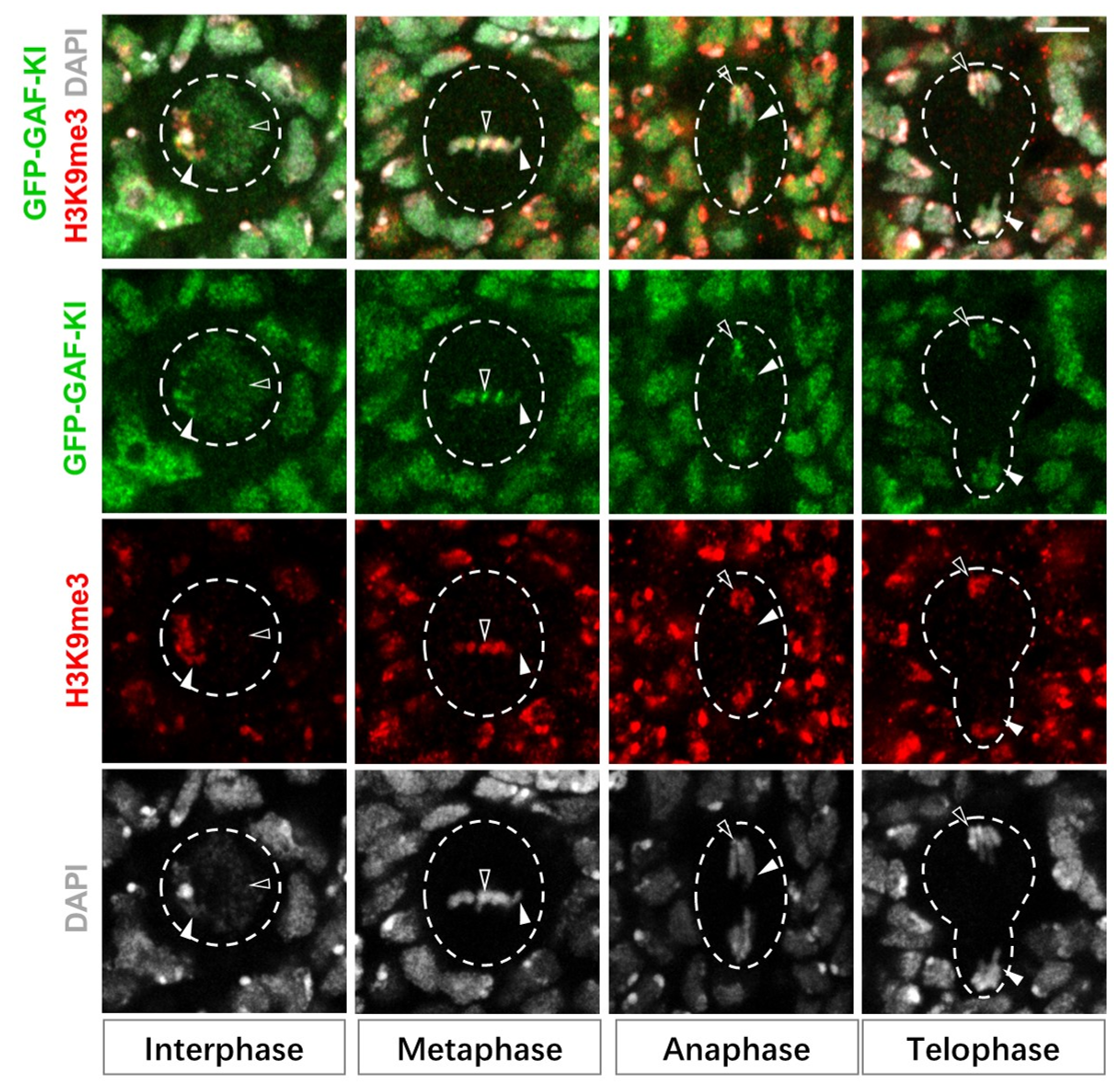
图1. 书签蛋白GAF保留在果蝇神经干细胞分裂期染色体上
借助实验室新近开发的鉴定发育脑中有丝分裂书签基因组结合位点的BISMIB组学技术 (Shen et al., STAR Protocols, 2025) 9 并结合精细的果蝇分子遗传学、细胞生物学、液-液相分离、生物化学和其它多组学技术,研究人员发现,在果蝇中脑区II 型神经干细胞不对称分裂过程中,关键促分化基因位点被先锋因子GAF(GAGA因子)及组蛋白修饰H3K27ac两个有丝分裂书签“双重标记”。在新生的维持神经干细胞命运的子细胞中,GAF通过组蛋白去乙酰化酶HDAC1介导的H3K27去乙酰化“删除”H3K27ac 书签,及时抑制促分化基因的转录,进而确保神经干细胞自我复制的命运;与之相反,在即将分化为神经祖细胞的子细胞中,GAF在关键促分化基因位点上的结合被染色质重塑复合体SWI/SNF竞争性取代,H3K27ac标记因此得以保留并快速激活促分化基因的表达,进而确保神经祖细胞趋向分化的命运。因此,本研究揭示了一种全新的“拮抗性双重有丝分裂书签标记与选择性分子竞争相结合”的机制,实现细胞命运记忆在姐妹子细胞中的差异性继承。
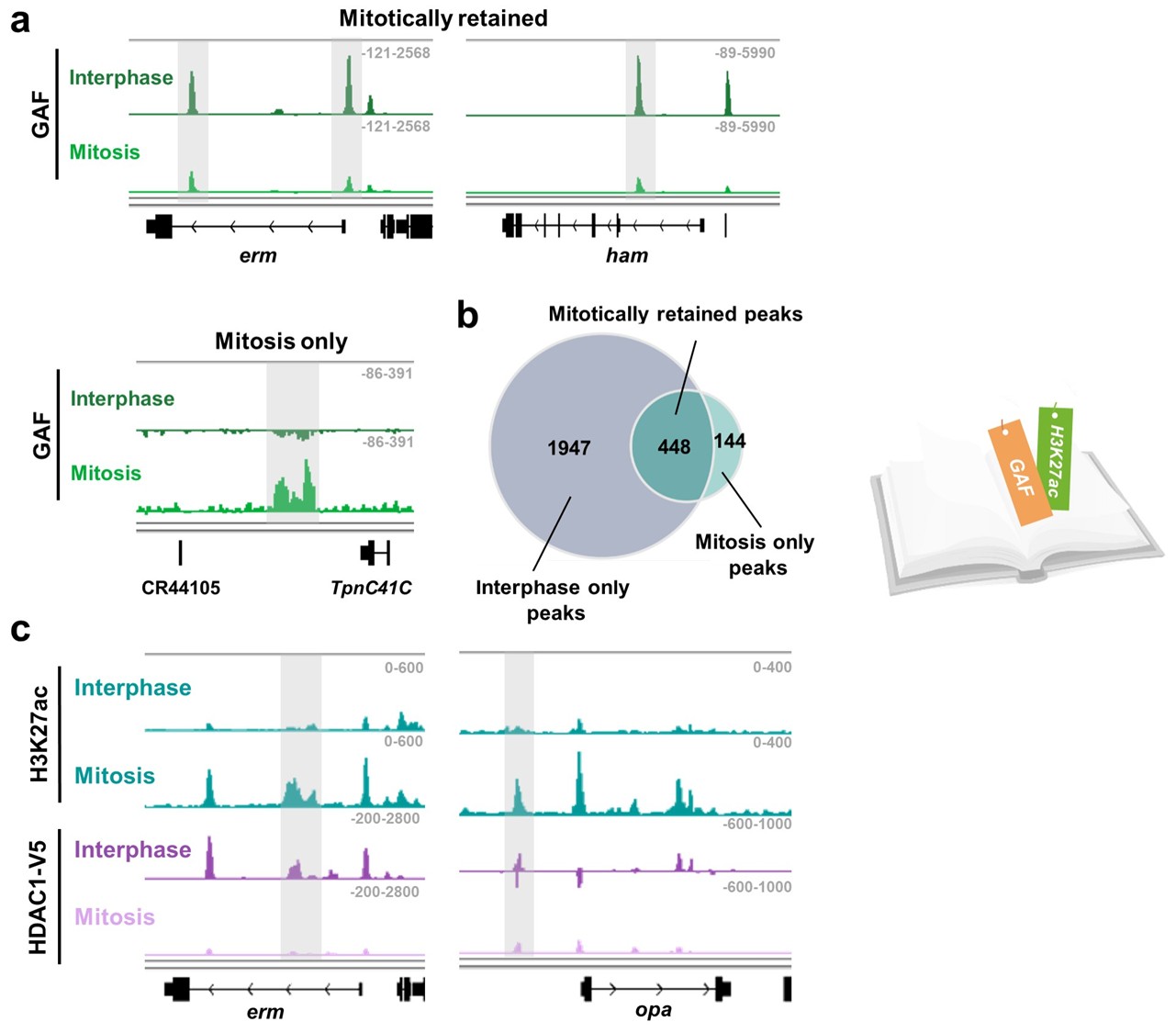
图2. 关键促分化基因在分裂期被GAF和H3K27ac 有丝分裂书签“双重标记”
综上所述,这项研究首次发现和提出有丝分裂书签可以“组合使用”。有丝分裂书签通过时空动态排列组合,大大拓展了其可能标记的基因位点和细胞类型,使得复杂多样的神经细胞命运记忆的精确储存和跨代继承成为可能,进而为极度精妙复杂的大脑构建过程保驾护航。
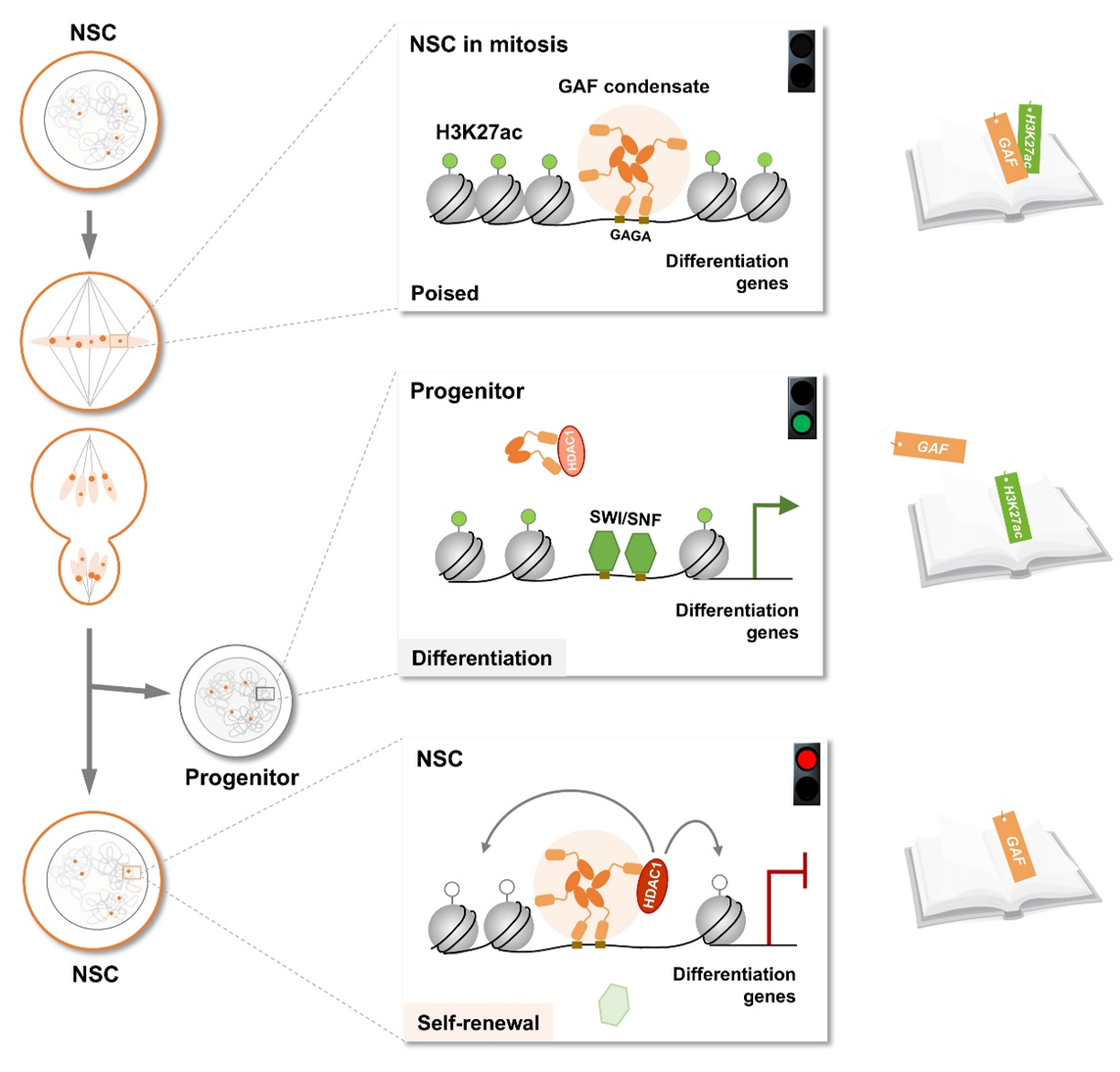
图3. GAF-H3K27ac双重有丝分裂书签标记协同调控脑发育中细胞命运记忆的差异传承
北京大学生命科学学院张如兰博士和博士研究生刘婕(2022级)为该论文的共同第一作者。北大-清华生命科学联合中心、北京大学生命科学学院宋艳研究员为该论文的通讯作者。课题组博士研究生陈紫莉(2023级)、申钰荧(将为加州大学圣地亚哥分校博士后)、兰泽君(2021级)、储竞仪(2021级)及本科生张梓茉(现为加州大学旧金山分校博士生)、汪探朋(2021级)、唐皓轩(现为哈佛大学博士生)、张曦月(2023级)等为本文做出了重要贡献。该研究得到了国家重点研发计划、国家自然科学基金、生命科学联合中心及膜生物学全国重点实验室的大力支持。
宋艳课题组综合运用多种研究手段从独特的视角探究脑发育中细胞命运决定及命运记忆维持或遗忘的分子调控机理,欢迎有志于探究细胞命运记忆传承机理的博士后、博士研究生和本科生加入。关于团队的更多介绍详见实验室网站:http://yansonglab.org/。
原文链接:https://www.nature.com/articles/s41467-025-62974-6
参考文献:
1. Siletti, K. et al. (2023). Transcriptomic diversity of cell types across the adult human brain. Science 382, eadd7046.
2. Holguera, I. & Desplan, C. (2018). Neuronal specification in space and time. Science 362, 176-180.
3. Martinez-Balbas, M.A., Dey, A., Rabindran, S.K., Ozato, K., and Wu, C. (1995). Displacement of sequence-specific transcription factors from mitotic chromatin. Cell 83, 29-38.
4. Koshland, D. & Strunnikov, A. (1996). Mitotic chromosome condensation. Annu Rev. Cell Dev. Biol. 12, 305-333.
5. Palozola, K.C., Lerner, J., and Zaret, K.S. (2019). A changing paradigm of transcriptional memory propagation through mitosis. Nat Rev Mol Cell Biol 20, 55-64.
6. Shen Y., Liu K., Liu J., Shen J., Ye T., Zhao R., Zhang R. and Song Y.* (2025) TBP bookmarks and preserves neural stem cell fate memory by orchestrating local chromatin architecture. Molecular Cell 85, 413-429.
7. Liu X.#, Shen J.#, Xie L., Wei Z., Wong C., Li Y., Zheng X., Li P. and Song Y.* (2020) Mitotic implantation of a transcription factor via phase separation drives terminal neuronal differentiation. Developmental Cell 52, 277-293.
8. Zhang R.#, Liu J.#, Zhang Z., Chen Z., Wang T., Shen Y., Lan Z., Chu J., Tang H., Zhang X. and Song Y.* (2025) Dual mitotic bookmarking by GAF and H3K27ac orchestrates differential propagation of cell fate memory in neural development. Nature Communications. doi.org/10.1038/s41467-025-62974-6
9. Shen Y., Liu J. and Song Y.* (2025) Protocol for identifying genomic binding sites of mitotic bookmarkers in Drosophila neural stem cells and cultured mammalian cells. STAR Protocols, doi.org/10.1016/j.xpro.2025.103858